|
Curso de Técnicas de Diagnóstico en Virología Animal |
5.-
Pruebas Inmunoenzimáticas
(ELISA)
Instituto
de Virología - C.I.C.V. - INTA
ELISA
OBJETIVO
DE LA TECNICA
Determinar
antígeno (Ag) o anticuerpo(Ac) en forma sensible y objetiva.
INTRODUCCION
Para
cuantificar pequeñas cantidades de Ag o Ac no detectables por los métodos
convencionales pueden aplicarse técnicas que utilizan marcadores de alta
sensibilidad. El ELISA se basa en la utilización de superficies sólidas para
inmovilizar Ag o Ac, en la elusión a través de lavados de los reactivos que no
reaccionan y en la detección de la reacción a través de conjugados enzimáticos.
Las
enzimas pueden unirse a Ag, Ac u otras proteinas y los conjugados resultantes
conservan tanto la actividad enzimática como inmunológica. La degradación
enzimática de un sustrato cromógeno soluble brinda un factor de amplificación
que facilita la detección sensible, precisa y cuantificable de las reacciones
Ag-Ac.
Ventajas
-Los
reactivos marcados con enzima son de alta estabilidad.
-Permite
una completa automatización.
-Los
resultados son objetivos y pueden ser cuantificados por un
espectrofotómetro.
-Los
Ag o Ac marcados con enzima pueden ser manejados en condiciones normales de
laboratorio.
Desventajas
-Diferente
afinidad de los Ag para adherirse a la fase sólida
-Presencia
de reacciones no específicas.
TIPOS
DE ENSAYO:
Para
medicion de antigeno
Para medición de anticuerpo
Competitivo
Competitivo
Sandwich
`
Indirecto (Figura 2)
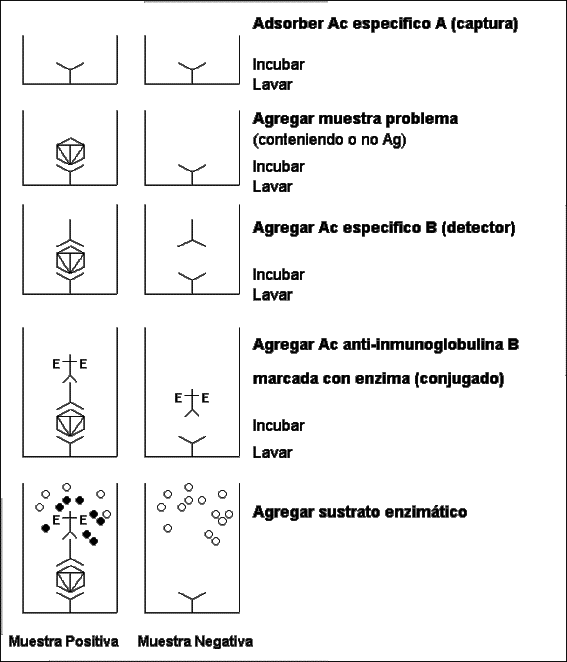
Sandwich indirecto (Figura 1)
Sandwich indirecto
BIBLIOGRAFIA
Afshar
, A., Shakarchi,N.H. and Dulac,G.(1993) Development of a competitive
Enzyme-linked immmunosorbent assay for detection of bovine, ovine, porcine and
equine antibodies to vesicular stomatitis virus. J.Clin Microbiol.31: 1860-1865.
Afshar,A.,
H.C. Trotter, G.C. Dulac, J.J. Reddington.(1993) Evaluation of a commercial
competitive ELISA test kit for the detection of group-specific antibodies to
bluetongue virus.
J
Vet Diagn Invest 5: 336-340
Hamblin,C.,
Barnett,I.T.R. and Hedger, R.S.(1986) Anew enzyme-linked immunosorbent assay
(ELISA) for the detection of antibodies against foot-and-mouth disease
virus.I.Development and method of ELISA. J.Immunol.Meth..93 :115-121
Horner,G.W.
and Orr,D.M. (1993) An
enzyme-linked immunosorbent assay for detection
of antibodies against bovine pestivirus. New Zealand Vet.Jour. 41:123-125.
Kramps,
J.A., Quak,S., Weerdmeester,K. and van Oirschot J.T.(1993)
Comparative study on sixteen enzyme-linked immunosorbent assays for the
deteection of antibbodiess tto bovine herpesvirus 1 in cattle. Vet.Microbiol., 35:
11-21.
PRACTICA:
ELISA INDIRECTO PARA DETECCION DE ANTICUERPOS ANTI-BHV-1
EQUIPOS
, MATERIALES Y SOLUCIONES
Lector de microplacas. Filtro 492 nm.
Microplacas de 96 pocillos
Immulon 1 (Dynatech Lab, USA, Cat No 011-010-3455)
Ovoalbumina (Fluka Biochemika, Switzerland, Cat No 05461 ) . Conservar a + 4oC.
Tween 20 (Polioxietilen sorbitano
monolaurate).
Conjugado anti-bovino peroxidasa (Dako Corporation Cat No P
) . Diluído 1/2 en glicerol y conservado a -20oC.
Peróxido de hidrógeno. Conservar a + 4oC protegido de la luz.
Materiales
a)
Antígeno positivo o infectante. Preparado con cepas de referencia y titulado.
Antígeno
control o negativo. Preparado a partir de cultivos celulares no infectados y
titulado.
b)
Suero: Problema, control positivo y negativo diluídos en PBST-OVA.
c)
Conjugado. Anti-gamaglobulina bovina marcada con peroxidasa conservada en forma
concetrada y titulada.
d)
Microplacas. Dynatech INMUNOLON I o NUNC cod. 2-69620.
e)
Soluciones. PBST, PBST-OVA, Buffer carbonato-bicarbonato, ABTS, H202 3%.
f)
Otros materiales. Micropipetas, tips, gradillas, tubos eppendorf etc.
Producción
del Antígeno.
a)
Se infectan frascos rollers de TFB o MDBK de 24 horas con virus BHV-1 a una
m.o.i.= 0,1; otros frascos se inoculan con PBS. Luego de 45 minutos de adsorción
se le agrega medio de mantenimiento
sin suero.
b)
Se cosecha cuando el efecto citopático es confluente, agitando para levantar
las células.
c)
Se congela y descongela 3 veces.
d)
Se centrifuga a 10000 rpm, a 4 C, 30 minutos y se descarta el sedimento.
e)
Se ultracentrifuga el sobrenadante a
4 C, 40000 rpm, 60 minutos y se conserva el sedimento.
f)
Los pellets se resuspenden en buffer NET ( 0,3 ml aprox. por tubo, luego se
lavan con 0,5 ml todos los tubos ) con pipeta pasteur y jeringa con aguja intradérmica.
g)
Se clarifica 2 minutos a 10000 rpm.
h)
Se fracciona y conserva a -70 C.
i)
El mismo procedimiento se sigue para las células no infectadas.
Titulación
del Antígeno
a)
Se efectúan diluciones del antígeno control ( células no infectadas ) y del
positivo ( células infectadas con el virus ) en buffer carbonato-bicarbonato
ph=9,6.
b)
Se realiza un ELISA enfrentando diluciones de antígeno control ( Ag - ) y del
Ag+ ( diluciones dobles a partir de 1/10 ) a diluciones de sueros controles
negativos y positivos conocidos ( cuadruples partiendo de 1/40 ).
c)
La máxima dilución de antígeno que otorga mayores diferencias entre Ag+ menos
Ag- para el suero positivo y en donde las diferencias son nulas para el suero
negativo se fijará como título.
Metodología
a.
Sensibilización de la placa
Diluir,el Ag+ y el Ag- en buffer carbonato,
de acuerdo a lo establecido en la titulación.
Depositar 50 ul de Ag- y Ag+ en pocillos
impares y pares respectivamente . Homogeneizar bien antes de sembrar.
Incubar la placa tapada toda la noche a 4 C.
Descartar el Ag excedente y secar sobre papel
absorvente.
Lavar 3 veces con PBS-T.
b.
Bloqueo
Depositar 75 ul de buffer de bloqueo por
pocillo.
Incubar a 37 C, 30 min. con agitación o 60
min. sin agitación.Descartar el buffer y secar con papel absorvente.
c.
Agregado de sueros problema y sueros controles
Se realizarán diluciones 1/40 de los sueros
problema y sueros controles positivo y negativo en PBST-OVA.
Si se requiere una determinación
cuantitativa se realizarán diluciones cuadruples a partir de 1/40 (p.ej. 1/160,
1/640, 1/2560)
Se colocará 50 ul de cada suero en pocillo
con Ag- y Ag+ .
Incubar a 37 C 30min. con agitación o 60
min. sin la misma.
Lavar 3 veces con buffer de lavado.
d.
Agregado del conjugado
Depositar 50 ul de conjugado, diluido de
acuerdo al título (en PBST-OVA) en
todos los pocillos.
Incubar a 37 C, 30 min. con agitación o 60
sin la misma.
Lavar 5 veces con PBST.
e.
Agregado del sustrato
Disolver 300 ul de ABTS en 12 ml de buffer
citrato, una vez disuelto agregar
60 ul de H2O2 al 3%.
Depositar 100 ul en todos los pocillos.
Leer a los 20 min. sin frenar la reacción.
f.
Lectura visual
Se registra la validéz de la prueba
observando los controles.
Control positivo: La intensidad de color en
el pocillo con Ag+ deberá ser
superior a la del pocillo con Ag-.
Control negativo: Las intensidades deberán
ser iguales, a veces es superior la
del pocillo con Ag-.
Una muestra es positiva cuando las
diferencias que se presentan entre
Ag+ y Ag- son visibles.
Una muestra es negativa cuando al comparar
dichos pocillos no hay diferencias, o cuando el Ag- diera más intensidad de
color que el Ag+.
Una muestra es dudosa cuando las diferencias
son mínimas entre los pocillos. En este caso dosar el suero por otra técnica
(IFI o SN).
g.
Lectura espectrofotométrica ( a 410 nm)
Se calcula para cada suero la densidad óptica
(DO) corregida (DO Ag+ menos Ag-).
Una muestra es positiva cuando la DO
corregida es = o > a 0,20.
Una muestra es negativa cuando la DO
corregida es inferior a 0,15.
Una muestra es dudosa cuando la DO corregida
esta entre 0,15 y 0,20.c
h.
Determinación cuantitativa
Lectura visual: el punto final es la máxima
dilución de suero que presenta diferencias visibles entre Ag+ y Ag-.
Lectura espectrofotométrica: el punto final
es la máxima dilución de suero cuya DO corregida es = o > a 0,11.
Soluciones
-Buffer
NET
Trizma
base
1,514 g
ClNa
0,12 M
1,753 g
EDTA
0,01 M
0,931 g
H
Cl 1 N
7,5 ml
H2O
dest. c.s.p.
250
ml
-Buffer
carbonato-bicarbonato PH 9,6
Carbonato
disódico (CO3Na2)
0,159 g
Carbonato
monosódico (CO3HNa
0,293 g
Agua
destilada c.s.p.
100 ml
-Buffer
de lavado - PBS- Tween 20- 1X (PBST)
Se
prepara PBS 10X
ClNa
80 g
KH2PO4
2 g
Na2HPO
12H2O 29
g
KCl
2 g
H2O
dest. c.s.p. 1000 ml
A
esta solución se le agrega ( a temp. ambiente y bajo agitación permanente ) 5
ml de Tween 20. Conservar a 4 C por poco tiempo ( no más de un mes ). Para su
uso diluir 100 ml de PBST 10X con 900 ml de H2O destilada, ajustar el ph a
7.4-7.6 con OHNa 1 N.
-Buffer
de Bloqueo
PBST
1X
99 ml
Ovoalbúmina
(OVA) 1 ml
Buffer
sustrato ABTS 40 mM
Solución
madre: 0.22 g ABTS
10 ml buffer citrato
Guardar a 4 C en frasco de color caramelo
Solución
de uso: 150 ul solución madre
+ 6 ml buffer citrato
+ 30 ul H2O2 3 %.
-Buffer
citrato
ph=
5
0.96
g ácido cítrico
Agregar
90 ml de H2O bidestilada
Ajustar
con OHNa 1 N a ph 5 (+ o - 10 ml)
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
ELISA
sandwich-antiglobulina para ensayo de antigeno

ELISA
indirecto para determinacion de anticuerpo
